如何掌握高考化学三大守恒定律
三大守恒定律是化学高考的必考点,还是重点难点,更是解决高考大题必不可少的技巧。如何写出化学中三大守恒式,化学姐带领大家通过5分钟课堂快速掌握。
名师答疑
【问异同】三大守恒的联系与区别

电荷守恒规律:电解质溶液中,不论存在多少种离子,溶液总是呈电中性。
阴离子所带的负电荷=阳离子所带的正电荷总数
物料平衡是元素守恒:要明晰溶质进入溶液后各离子的去向。由于水溶液中一定存在水的H、O元素,所以物料守恒中的等式一定是非H、O元素的关系。
⒈含特定元素的微粒(离子或分子)守恒
例如:
在0.2mol/L的Na2CO3溶液中,根据C元素形成微粒总量守恒有:
c(CO32-) + c(HCO3-) + c(H2CO3) = 0.2mol/L。
⒉不同元素间形成的特定微粒比守恒
例如:
在Na2CO3 溶液中,根据Na与C形成微粒的关系有:
c(Na+) = 2[c(CO32- ) + c(HCO3- ) + c(H2CO3 )]
分析:上述Na2CO3 溶液中,C原子守恒,n(Na) : n(C)恒为2:1
3.混合溶液中弱电解质及其对应离子总量守恒
例如:
相同浓度的HAc溶液与NaAc溶液等体积混合后,混合溶液中有:
2c(Na+ )=c(Ac-)+c(HAc)
分析:上述混合溶液中,虽存在Ac-的水解和HAc的电离,但也仅是Ac-和HAc两种微粒间的转化,其总量不变。
质子守恒规律:水电离的特征是c(H)=c(OH-),只不过有些会水解的盐会导致氢离子、氢氧根可能会有不同的去向,我们需要把它们的去向全部找出来。
例如:
NaHCO3溶液,初始H+ 来源于HCO3- 和H2O的电离,
c初(H+) = c(CO32- ) + c(OH- );
伴随着的水解的发生,一部分H+转化到H2CO3中,因此,
c初(H+) = c现(H+) + c(H2CO3 ),
从而得出,溶液中离子浓度的关系如下:
c(CO32- ) + c(OH- ) = c(H+) +c(H2CO3 )
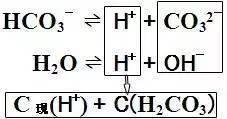
对同一溶液来说:
质子守恒=电荷守恒-物料平衡
【问疑难】快速书写质子守恒的方法
第一步:确定溶液的酸碱性,溶液显酸性,把氢离子浓度写在左边,反之则把氢氧根离子浓度写在左边。
第二步:根据溶液能电离出的离子和溶液中存在的离子,来补全等式右边。具体方法是,判断溶液你能直接电离出的离子是什么。然后选择能电离产生氢离子或者水解结合氢离子的离子为基准,用它和它电离或者水解之后的离子(这里我称它为对比离子)做比较,是多氢还是少氢,多N个氢,就加上N倍的该离子(对比离子)浓度。少N个氢离子,就减去N倍的该离子(对比离子)。
总结归纳
1.Na2CO3溶液
电荷守恒:
c(Na+ )+c(H+ )=c(OH-) +c(HCO3- )+2c(CO32- )
物料守恒:
c(Na+ )=2[c(CO32- )+c(HCO3- )+c(H2CO3 )]
质子守恒:
c(OH- )=c(H+ )+c(HCO3- )+2c(H2CO3 )
2.NaHCO3溶液
电荷守恒:
c(Na+ )+c(H+ )=c(HCO3- )+2(CO32- )+c(OH-)
物料守恒:
c(Na+ ) =c(HCO3- ) + c(CO32- ) + c(H2CO3 )
质子守恒:
c(H+ )=c(CO32- )+c(OH- ) -c(H2CO3 )
即c(H+ )+c(H2CO3 )=c(CO32- )+c(OH- )
3.NH4Cl溶液
电荷守恒:
c(NH4+ )+ c(H+ )=c(Cl- )+ c(OH- )
物料守恒:
c(NH4+ )+ c(NH3.H2O)= c(Cl-)
质子守恒:
c(H+ )= c(OH- )+ c(NH3.H2O )
4.Na3PO4溶液
电荷守恒:
c(Na+ )+c(H+ )=3c(PO4 3-) +2c(HPO42- )+c(H2PO4- )+c(OH-)
物料守恒:
c[Na+ ]=3c[PO4 3-] + 3c[HPO42- ] + 3c[H2PO4- ]+3c[H3PO4 ]
在0.1mol/L Na3PO4溶液中,根据P元素形成微粒总量守恒有:
c[PO43- ]+c[HPO42- ]+c[H2PO4- ]+c[H3PO4 ]=0.1mol/L
质子守恒:
c[OH- ]=c[HPO42-]+2c[H2PO4-]+3c[H3PO4]+c[H+]
5.Na2S溶液
电荷守恒:
c(Na+ )+c(H+ )=2c(S2-)+c(HS-)+c(OH- )
物料守恒:
c(Na+ )=2[c(S2- )+c(HS- )+c(H2S)]
质子守恒:
c(OH-)=c(H+ )+c(HS- )+2c(H2S)
解题妙招
好了,还有最后一个问题,在判断的时候,我们怎么先去确定一个等式,它到底是哪个守恒呢?肿么破?急等……
客官莫及,方法来了。
如果等式中只有离子,没有分子,那就是电荷守恒(这不废话吗……分子哪有电荷啊)。
如果等式中有分子,但是没有氢离子和氢氧根,那就是物料守恒。
如果等式中既有分子,又有氢离子和氢氧根离子,那就是质子守恒。
是不是很简单。
最后我们总结一下,这类题的思路:先判断是哪个守恒,然后该咋地咋地。
相信大家已经按耐不住要去尝试了吧,去吧去吧……
- 男生最喜欢的异性女朋友
- 不良的暴力色情玩具风靡校园
- 美国NBA篮球球星科比“亚洲行”
- NBA著名中锋“大鲨鱼”奥尼尔拜访少林寺
- 昔日校园才女 今朝军中“花木兰”
- “超人”博尔特再创百米历史
- 泰国公主再次来到北大并走入了春日里的燕南园
- 金融危机下招聘场面依然火爆
- 玩老游戏使他们回到童年
- 北外:2008年春季研究生毕业典礼
- 思念是最美丽的图案
- 最惊人的一幕
- 在美国小学生居然也过情人节
- 陈楠与美国女子篮球队友训练
- 舒适而高雅的静守
- 少女为就父亲跪街卖肾
- 大学生离校 情侣上演离别戏
- 蜡像诺维茨基真假难辨
- 从数字看到珍惜拥有
- 张艺谋钦点奥运宝贝之一及“绝密”隐私
- 英足传奇人物博比·罗布森因癌症去世
- 为奥运会热身颁奖礼仪小姐
- 雷人片:大一美男生演贵妃
- 最有创意的麻将牌
- 最有想象力的孩子