当前位置:
查字典高考网 > 高考总复习 > 高考化学知识点 > 【每日一题】弱电解质的电离、盐的水解
【每日一题】弱电解质的电离、盐的水解
发布时间: 2017-05-08 来源:查字典高考网
常温下含碳各微粒H2CO3、HCO3-和CO32-存在于CO2和NaOH溶液反应后的溶液中,它们的物质的质量分数与溶液pH的关系如图所示,下列说法错误的是:
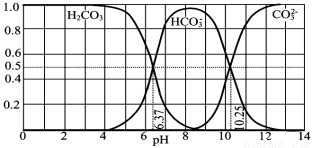
A.pH=10.25时,c(Na+)=c(CO32-)+c(HCO3-)
B.为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
C.根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D.若是0.1molNaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系: c(Na+)c(HCO3-)c(CO32-)c(OH-)c(H+)
答案与解析
解析:A.由图像可知,pH=10.25时,c(CO32-)=c(HCO3-)=0.5mol/L,则该溶液是等物质的量的Na2CO3、NaHCO3的混合溶液,溶液中c(Na+)=2c(CO32-)+c(HCO3-),A项错误;B.由图像可以看出,pH=8作用,溶液中的含碳微粒主要是HCO3-,所以为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间,B项正确;C.根据图像,pH=6.37时,c(H2CO3)=c(HCO3-)=0.5mol/L,根据H2CO3H++HCO3-,Ka1(H2CO3)=[c(H+)c(HCO3-)]c(H2CO3)=c(H+)= 10-6.37,C项正确;D.根据图像可知,pH=10的溶液中,c(HCO3-)=0.6mol/L,c(CO32-)=0.4mol/L,则溶液中存在以下关系c(Na+)c(HCO3-)c(CO32-)c(OH-)c(H+),D项正确。
答案:A
查看全部
大家都在看
- 高三学生要利用好寒假
- 高考复读生应如何有效地进行复习
- 缓解考前心理焦虑三招
- 08高考数学复习:平面向量解题要点与实际应用
- 高三数学复习的“二八四三”原则
- 高三寒假如何查漏补缺
- 2008年高考复习:抓住知识梳理的“黄金期”
- 2008年各学科高考复习大纲及高考命题研究
- 四种方法提高英语阅读速度
- 高三寒假父母如何做好后勤
- 期末考试复习的方法
- 名师指导高三期末“小模考”
- 高三生必看:备战高考的30条有用经验
- 08高考数学复习:三角函数专题热点复习指导
- 高三必读:别让这个寒假成为高中生活的遗憾
- 高考美术艺术考生备考技巧
- 备战高考——高考各科骨干教师谈高考复习
- 英语,从近两年考试中找方向
- 高三学生要利用好最后一个寒假
- 高考复习备考六大经典环节
- 王金战:高三寒假如何冲刺?
- 高三寒假测试:遇到压力你会怎么做
- 2008年高考大纲变化重点
- 美国高考数学考试相当于中国初中水平
- 名师推荐:高考数学知识速记口诀